植物过氧化物酶POD活性测定试剂盒(分光法)
Plant Peroxidase Activity Assay Kit(Spectrophotometer Method) Ver.751165-2.0
|
货号
|
名称
|
规格
|
|
PD1050F
|
植物过氧化物酶POD活性测定试剂盒(分光法)
|
100次
|
● 产品组成:
|
组分货号
|
名称
|
规格
|
贮存
|
|
PD1050F-01
|
提取缓冲液
|
100 ml
|
4℃
|
|
PD1050F-02
|
试剂1-显色剂
|
25 ml
|
4℃,避光
|
|
PD1050F-03
|
试剂2-分析缓冲液
|
80 ml
|
4℃
|
|
PD1050F-04
|
试剂3-酶底物
|
6 ml
|
4℃,避光
|
● 产品简介:
过氧化物酶(Peroxidase,POD)是一种活性较高、广泛存在于植物组织器官中的氧化还原酶,以铁卟啉为辅基,能催化过氧化氢(H2O2)直接氧化酚类或胺类化合物,具有消除过氧化氢和酚类、胺类毒性的双重作用,有效防止过氧化氢在体内的积累,从而对植物体起到保护作用;同时,过氧化物酶能使植物组织中所含的某些碳水化合物转化成木质素,是细胞木质素合成途径中间的关键酶。所以,POD与植物体内物质代谢及抗逆性都有着密切关系。
测定原理:用愈创木酚(即邻甲氧基酚,GA,Guaiacol)为过氧化物酶的底物,在过氧化物酶催化下,过氧化氢可将愈创木酚氧化成红棕色的2-邻甲氧基苯酚(2-GA),反应方程式2H2O2 + 2GA→2-GA + 4H2O,2-GA在470 nm处有最大吸收,故可通过测470 nm下吸光值变化测定过氧化物酶活性。
该试剂盒使用分光光度计,用1 ml比色皿测定植物样品中的POD活性,以每次提取使用1 ml提取液,1 ml反应体系计算,该产品可以大约使用100次。
本试剂盒适用于检测植物组织中的过氧化物酶(POD)活力,不推荐用于动物组织、动物细胞、细菌以及血清样品中POD的检测。
● 贮存、运输及效期:
4℃贮存;常温运输;有效期一年。
● 自备材料:
植物材料;研钵;石英砂;聚乙烯聚吡咯烷酮(PVPP);1 ml玻璃比色皿(光程1 cm);分光光度计仪(检测波长470 nm);低温台式离心机;可调式移液器;冰;蒸馏水。
● 实验准备:
1. 分光光度计预热30 min,设定波长到470 nm。
2. 测定前提前30 min取出试剂1、 试剂2和试剂3,平衡至常温(25℃)。
3. 提前打开制冰机。
● 操作步骤:
建议正式实验前,选取2个样本做预测定,了解实验样品情况,熟悉流程,避免样本和试剂浪费。
一. 样本POD提取:
1.1 取新鲜植物组织,按照组织质量(g):提取液体积(ml)为~1:10的比例用研钵进行冰浴研磨,制备成~10%植物匀浆液,如0.1 g 植物叶片,加入1 ml提取液,用研钵进行冰浴研磨。
注:对于纤维含量多的植物如水稻叶片,可加入适量石英砂(试剂盒不提供,自备)辅助研磨,提高研磨效率;对于多糖多酚含量高的植物,可以在提取液中加入1% PVPP(试剂盒不提供,自备),能有效去除多糖多酚对活性测定的干扰。
1.2 12000 rpm,4℃离心10 min,取上清,即为含有POD的样本,置冰上测定。
注:提取的样本如需贮存,4℃贮存3天;建议按需分装后-80℃贮存,两周内使用,尽量避免反复冻融;不建议-20℃贮存。
二. 样本测定:
2.1 在1.5 ml离心管中依次加入:
|
加入顺序
|
试剂名称
|
对照体系
|
测定体系
|
|
|
|
反应总体积1 ml
|
|
1
|
样本
|
-
|
x
|
|
2
|
试剂1-显色剂
|
200
|
200
|
|
3
|
试剂2-分析缓冲液
|
750
|
750-x
|
|
4
|
试剂3-酶底物
|
50
|
50
|
|
离心管中混匀后,用对照体系将仪器调零;随后立即将反应体系转移到1 ml比色皿中,在 470 nm处读取吸光值 A1以及反应时间后的吸光值A2,△A=A2-A1,可以间隔1 min读数,读取5 min内的数值。
|
|
注1:10%植物匀浆液x经验值一般为50-200
μl。
注2:若吸光值的上升趋势不稳定,可全部加完所有试剂后读取5 min内每间隔1 min的吸光值,根据时间对吸光值做线性回归曲线,选取一段线性增长范围读取△A值(参见实验示例)。
|
2.2 由于植物样本繁多,不同物种的POD活性差异很大,有的物种活性很高(反应启动后混合液颜色很快由橘黄色变为红褐色);有的物种活性很低(反应启动后 5 分钟内混合液不变色,吸光值只有小数点后三位的变化)。强烈建议先取 2-3 个样本做个预测定,如果反应启动后混合液颜色很快由橘黄色变成红褐色,A1值大于0.6
或 A2 值大于1.5 或ΔA大于1,说明酶活性过高,可降低样本量 x,也可将样本用提取缓冲液稀释后(稀释倍数为D)重新检测。如果 A1 值很小(<0.02),且△A 很小(<0.005,随时间延长A470几乎不变化),且反应启动后一段时间没有显色(一般5 min内),说明酶活性很低,可增加样本量x。
三. 活性计算:
3.1 按样本鲜重(FW)计算:
3.1.1 酶活定义:每克植物组织鲜重(FW)每分钟在1 ml反应体系中使470 nm 处吸光值增加1为一个酶活力单位U。
计算公式:POD活性(U/g FW)=
?AFW×1T×V总V样×D
注解:
△A:在时间T内A470的增加值
FW(g):样本提取中使用植物材料的鲜重克数
T(min):读取两次A470的间隔反应时间
V总(ml):样本提取中加入提取液的总体积
V样(ml):微孔板中加入的样本体积x μl,转换为ml数
D= 样本稀释倍数,未稀释为1
3.1.2 计算示例:
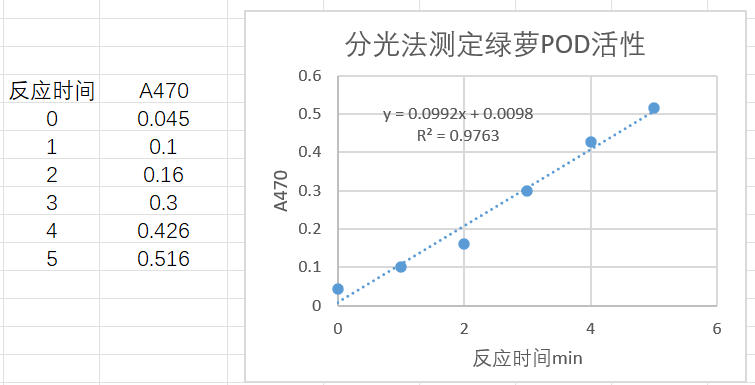
取0.5 克绿萝叶片(FW=0.5),加入5 ml提取液(V总=5)冰浴匀浆,制成10%匀浆液,12000 rpm 4℃离心10 min,取上清置于冰上,取50 μl样本(V样=0.05)按照测定步骤操作,使用1 ml石英比色皿(光径1 cm),设定分光光度计检测波长470 nm,间隔1 min记录数据,采集5次;时间对吸光值做线性回归曲线,3-4 min线性较好,1 min内△A=0.426-0. 3=0.126。计算POD(U/g FW)=0.126/0.5×1/1×5/0.05×1= 25.2 U/g FW
3.2 按样本蛋白浓度计算:
3.2.1 注:此方法需要测定样本的蛋白浓度,推荐使用BCA蛋白浓度测定试剂盒(货号:RTP7102)。
酶活定义:每毫克蛋白(mg prot)每分钟在1 ml反应体系中使 470 nm 处吸光值增加1为一个酶活力单位 U。
计算公式:POD活性(U/mg prot)=
?AV样×Cpr×1T×D
注解:
△A:在时间T内A470的增加值
V样(ml):酶促反应中加入的样本体积x μl,转换为ml数
Cpr:样本蛋白浓度(mg/ml)
T(min):读取两次A470的间隔时间
D:样本稀释的倍数,未稀释即为1
3.2.2计算示例:
绿萝POD活性测定-按样本蛋白浓度计算:取0.5 克绿萝叶片,加入5 ml提取液冰浴匀浆,制成10%匀浆液,12000 rpm 4℃离心10 min,取上清置于冰上,BCA蛋白定量试剂盒(货号:RTP7102)测定蛋白浓度为2 mg/ml(Cpr=2);按照测定步骤操作,取50 μl样本(V样=0.05)测定,设定酶标仪检测波长470 nm,间隔1 min采集数据,采集5次;时间对吸光值做线性回归曲线,1-6 min(T=5)线性较好,5 min内△A=0.459-0.067=0.392。计算公式: POD(U/mg prot)=0.392/(0.05×2)×1/5×1=0.784 U/mg prot。
