BCIP/NBT 碱性磷酸酶显色液(预混型)
BCIP/NBT Solution,Premixed
|
货号
|
产品名称
|
包装
|
|
BN1026
|
BCIP/NBT 碱性磷酸酶显色液(预混型)
|
100ml
|
|
-
|
说明书
|
一份
|
● 产品简介:
BCIP (5-Bromo-4-chloro-3-indolyl phosphate)
5-溴-4-氯-3-吲哚基-磷酸盐+NBT (四唑硝基蓝) 是碱性磷酸酶(AP)最佳的底物组合之一。在碱性磷酸酶的催化下,BCIP会被水解而产生强反应性的产物,该产物与NBT发生反应,形成不溶性的深蓝色至蓝紫色化合物。该试剂盒可用于AP系统的IHC 和Western Blot 实验的酶促显色。在AP催化下,在组织切片或印迹膜上结合了AP偶联物的地方产生深蓝色沉淀,可根据颜色反应来确定目的蛋白的位置及表达情况。
本染色液为即用型工作液,可以直接使用,不用稀释。
● 贮存、效期及运输:
2-8℃保存;一年有效;常温运输。
● 使用说明:
1. 印迹膜显色:
1.1 印迹膜显色前要用1×TBST漂洗3次,每次5-10分钟。不要用1×PBST漂洗,因为无机磷是AP的强烈抑制剂。
1.2 将印迹膜完全浸入到适量BCIP/NBT 显色液中,常温避光孵育 10-20 分钟,至膜上条带清晰可见。显色完毕后,将膜浸入水中,终止反应。
2. 组织切片或细胞爬片显色:
滴加适量的BCIP/NBT显色液于需要显色的组织切片或细胞爬片上,常温避光孵育10-20分钟。显微镜下观察控制显色时间,当达到最佳显色效果后,自来水冲洗终止显色。显色后的切片经复染、脱水透明,封片后可长期保存。
实验示例:
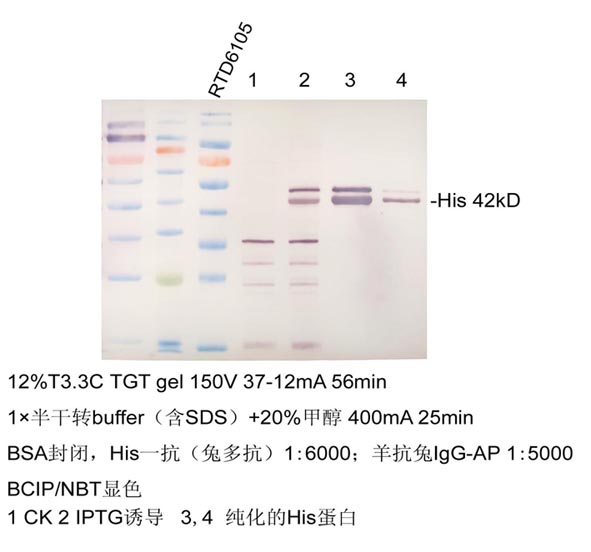
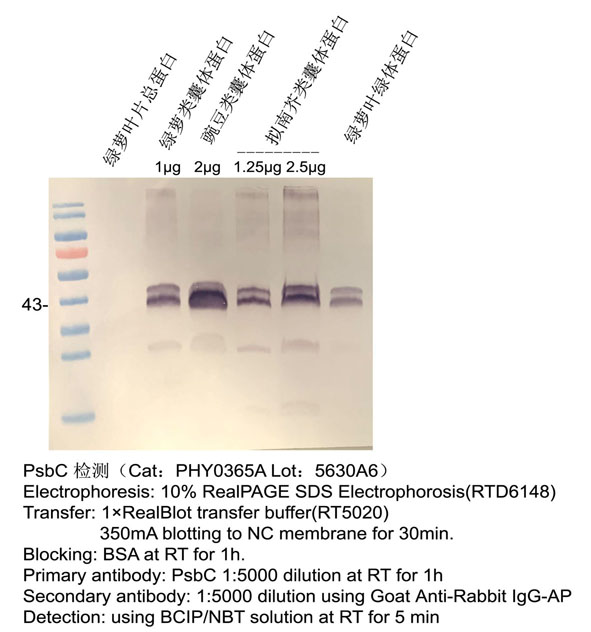
一、什么是BCIP/NBT显色?
BCIP/NBT 显色是生物实验中检测碱性磷酸酶(Alkaline Phosphatase, AP)活性的经典可视化技术,通过 “酶促反应 + 化学沉淀” 将 AP 的活性位点转化为可直接观察的蓝紫色信号,广泛用于 Western Blot、免疫组化(IHC)、原位杂交(ISH)等实验,核心是通过底物组合实现 “无形酶活性” 到 “有形显色信号” 的转化。
二、BCIP/NBT显色原理?
BCIP/NBT 的显色过程依赖酶促水解与氧化还原沉淀的协同作用,最终生成不溶性蓝紫色沉淀,具体分两步进行:
主要成分
-
BCIP(5 - 溴 - 4 - 氯 - 3 - 吲哚基磷酸酯):AP 的特异性底物,为磷酸酯类化合物,可被 AP 催化水解。
-
NBT(氯化硝基四氮唑蓝):电子受体(氧化还原指示剂),本身是淡黄色可溶性粉末,接受电子后会转化为蓝紫色不溶性沉淀。
反应机制
步骤 1:AP 催化 BCIP 水解(酶促反应)
碱性磷酸酶的核心功能是水解磷酸酯键,实验中需用 Tris-HCl 缓冲液维持pH 9.0-10.5(AP 最适活性环境),在此条件下:AP 特异性结合 BCIP 分子上的磷酸基团,将其水解为两种产物:
-
-
5 - 溴 - 4 - 氯 - 3 - 吲哚酚 :性质不稳定,会迅速发生下一步氧化反应。
步骤 2:吲哚酚氧化与 NBT 还原(化学沉淀反应)
不稳定的 “5 - 溴 - 4 - 氯 - 3 - 吲哚酚” 具有强还原性,会自发发生二聚化(氧化反应) ,同时将电子转移给体系中的 NBT(电子受体):
-
吲哚酚:失去电子被氧化,二聚形成无色的 “吲哚酚二聚体”;
-
NBT:接受电子被还原,从淡黄色可溶性状态转化为蓝紫色甲臜(Formazan)衍生物。
最终,“吲哚酚二聚体” 与 “蓝紫色甲臜” 通过非共价作用结合,形成不溶性蓝紫色沉淀,精准沉积在 AP 所在位置(如 Western Blot 条带、IHC 抗原位点),实现可视化检测。
三、BCIP/NBT显色实验注意事项?
BCIP/NBT 显色的成功率与实验细节密切相关,需重点关注以下维度,避免背景过高、显色微弱或失败:
缓冲液与 pH 控制(关键前提)
-
必须维持碱性环境:AP 活性严格依赖 pH 9.0-10.5(常用 0.1M Tris-HCl 缓冲液,可添加 50mM MgCl2增强 AP 活性);若 pH<8.0,AP 活性会显著抑制,导致显色缓慢或不显色;若 pH>11.0,会导致 BCIP/NBT 自发分解,产生非特异性背景。
-
避免缓冲液污染:缓冲液需新鲜配制,若混入磷酸酶(如环境中的杂质酶),会导致 “假阳性” 背景,建议配制后 4℃短期保存(不超过 1 周)。
底物配制与保存(避免失效)
-
现配现用:BCIP 和 NBT 通常为粉末状(需 - 20℃避光保存),使用前用二甲基甲酰胺(DMF)或水溶解(按说明书比例,如 NBT 50mg/mL、BCIP 50mg/mL),配制成母液后立即稀释到缓冲液中(工作液需当天使用);长期放置会导致底物氧化,出现预沉淀。
-
避光操作:NBT 对光敏感,遇光易自发还原为蓝紫色沉淀,因此底物母液、工作液需避光保存(用棕色瓶),显色过程也需在避光条件下进行(如用铝箔包裹反应容器)。
反应温度与时间(控制显色强度)
-
温度影响反应速率:室温(20-25℃)下显色较温和,适合精细调控;37℃会加速反应,但易导致背景过高(建议仅在显色缓慢时短期使用);避免低温(<15℃),会显著减慢反应,延长实验时间。
-
实时观察终止:显色过程需每隔 5-10 分钟观察(如 Western Blot 膜、IHC 切片),待目标信号(条带、阳性位点)清晰且背景较低时,立即用
TE 缓冲液(pH 8.0)或去离子水终止反应 —— 原理是终止 AP 活性,防止过度显色(背景加深、信号模糊)。
样本与试剂污染防控(避免假阳性 / 假阴性)
-
样本去磷酸化处理:若样本中含有内源性磷酸酶(如组织样本中的碱性磷酸酶),会导致非特异性显色,需提前用 “磷酸酶抑制剂”(如 Levamisole,适用于组织样本)处理,仅保留实验标记的 AP 活性。
-
试剂纯度:确保 BCIP、NBT 为 “分子生物学级”,避免杂质(如重金属离子)抑制 AP 活性;缓冲液中的 Mg2?需用无水 MgCl?(避免含结晶水导致浓度不准),Mg2?缺乏会降低 AP 活性。
-
后续处理(信号保存)
-
避免有机溶剂浸泡:显色后的样本(如 Western Blot 膜、IHC 切片)需用清水短暂冲洗,去除残留底物;若需固定,可使用中性福尔马林(IHC 切片)或甲醇(膜样本),但避免长时间浸泡在乙醇、丙酮等强有机溶剂中,可能导致沉淀溶解,信号减弱。
-
长期保存:膜样本可干燥后用保鲜膜包裹,室温避光保存;切片可封片(用中性树胶),避免潮湿环境导致沉淀褪色。
四、BCIP/NBT显色实验案例原因分析
非特异性背景过深
-
原因 1:抗体浓度过高或洗涤不充分→ 解决:优化一抗 / 二抗浓度(做梯度稀释预实验),延长洗涤时间(如 TBST 洗涤 4 次 ×10 分钟),洗涤液中可加入 0.05% Tween-20(增强去垢效果,减少非特异性结合);
-
原因 2:显色液光照降解或污染→ 解决:使用新鲜配制的显色液,全程避光操作,容器需无菌无酶;
-
原因 3:组织 / 膜自身含内源性 AP→ 解决:IHC 实验前可先用0.1% 左旋咪唑溶液(AP 抑制剂)孵育 15-30 分钟(抑制内源性 AP 活性,不影响标记抗体的 AP),Western Blot 膜无需额外处理(膜自身 AP 活性极低)。
-
原因 1:AP 酶活性丧失→ 解决:检查酶标抗体是否反复冻融(建议分装后 - 20℃保存),显色缓冲液是否漏加 MgCl2(AP 必需辅因子);
-
原因 2:底物失效→ 解决:观察显色液是否澄清(若出现浑浊或蓝色沉淀,说明已降解,需更换);
-
原因 3:抗原 - 抗体未结合→ 解决:排查一抗特异性(是否与目标蛋白匹配)、样本制备是否得当(如 Western Blot 中蛋白是否充分变性、转膜是否成功,可通过内参抗体验证)。
-
原因 1:显色液未充分覆盖或有气泡→ 解决:确保膜 / 切片完全浸没,滴加显色液时轻轻驱赶气泡;
-
原因 2:转膜不完全(Western Blot)→ 解决:检查转膜缓冲液是否新鲜(含 20% 甲醇,甲醇可增强蛋白结合膜的能力),转膜时间和电流是否合适(根据蛋白分子量调整,如 30kDa 以下蛋白需缩短转膜时间,避免穿透膜);
-
原因 3:组织切片脱片(IHC)→ 解决:实验前用多聚赖氨酸包被载玻片,增强切片与载玻片的结合力。